Het immuunsysteem heeft als taak om het lichaam te beschermen tegen pathogene micro organismen. Het zorgt ook voor de opruiming van vreemde celstructuren (zoals necrotisch of dood weefsel en tumorweefsel). Het beschikt hiervoor over aspecifieke, aangeboren mechanismen en specifieke, aangeleerde mechanismen.
Het aspecifieke immuunsysteem omvat verschillende elementen die het binnendringen van pathogenen in het lichaam tegengaan. Als dit toch gebeurt, zal het vreemde agens zo snel mogelijk onschadelijk gemaakt worden.
Het specifieke immuunsysteem wordt in de loop van de tijd opgebouwd. Bij een eerste contact worden de kenmerken van de indringer opgeslagen in een geheugen. Bij een later contact wordt de indringer meteen herkend zodat er snel en efficiënt kan worden gereageerd.
Uit proefdieronderzoek komt naar voren dat de microbiota noodzakelijk is voor een evenwichtige ontwikkeling van het immuunsysteem in de darm. Proefdieren zonder microbiota (gnotobiotische muizen) – met steriele darmen – hebben een onderontwikkeld immuunsysteem, zo blijkt uit onderzoek.[1] De villi en microvilli van de darm zijn kleiner dan bij dieren met een microbiota en hun darmfuncties als peristaltiek en epitheelvernieuwing zijn verminderd.
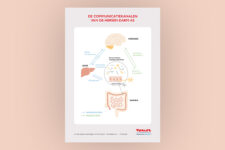
Het immuunsysteem

De belangrijkste elementen van het aspecifieke en specifieke immuunsysteem. (Bron: Roitt, Brostoff en Male 1996)
Effecten op de natuurlijke weerstand
De huid bestaat uit meerdere cellagen; de bovenste laag is verhoornd en dus moeilijk doordringbaar. De darmen daarentegen zijn maar één cellaag dik, zodat ze voedingsstoffen makkelijk kunnen opnemen. Om ziekteverwekkende bacteriën tegen te houden, moeten de darmen onderscheid kunnen maken tussen ‘goede’ en ‘slechte’ stoffen. Daarvoor wordt de natuurlijke weerstand aangesproken. Omdat de darmen zulk een groot en kwetsbaar oppervlak hebben, spelen ze een cruciale rol in ons immuunsysteem. De microbiota vormen de eerste verdedigingslinie tegen exogene en pathogene bacteriën. Bepaalde bacteriën kunnen antimicrobiële substanties aanmaken, zoals bacteriocines en organische zuren, om de groei van schadelijke bacteriën af te remmen. Het evenwicht tussen verschillende soorten residente bacteriën zorgt voor stabiliteit in de bacteriële populatie. Binnen een ecologische niche moeten diverse bacteriesoorten met elkaar wedijveren voor voedingsstoffen.[2, 3]
Effecten op het immuunsysteem
De samenstelling van de darmmicrobiota heeft een invloed op de immuunfuncties. Zo bezitten bv lactobacillen en bifidobacteriën het vermogen immuunreacties te moduleren. Sommige lactobacillen remmen de synthese van pro-inflammatoire cytokines (o.a. TNF-α en IL-12) en stimuleren de synthese van anti-inflammatoire cytokines (bv IL-10 of TGF-ß).[4] Versterking van orale tolerantie tegen oplosbare (auto)antigenen, kan auto-immuunziekten beperken. Het stimuleren van de IgA productie en het activeren van macrofagen kan bescherming bieden tegen ziekteverwekkers in de darm. De cytotoxische activiteit van macrofagen kan tumorgroei remmen. Verlaging van IgE niveau’s heeft een positief effect op bijvoorbeeld voedselallergieën.[5] Deze effecten hebben een enorm potentieel voor de preventie en therapeutische inzet voor het orale verbruik van lactobacillen en bifidobacteriën.
Invloed van de darmmicrobiota op het immuunsysteem en gezondheid

De rol van het darmgeassocieerde lymfeweefsel
Het gut associated lymphoid tissue (GALT) bestaat uit Peyerse platen, interepitheliale lymfocyten en macrofagen. De Peyerse platen (aggregaten van lymfeknopen) zijn bedekt met M-cellen. M-cellen zijn gespecialiseerde epitheelcellen, die specifieke plooien bevat (microfolds) en kunnen na endocytose vanuit het darmlumen, de opgenomen antigenen presenteren aan lymfocyten. Deze lymfocyten worden via lymfe of bloed naar een regionale mesenteriale lymfeklier of de milt vervoerd. In deze organen vindt een primaire immuunreactie plaats die leidt tot de vorming van IgM-antilichamen en IgM-geheugencellen. Het circulerende IgM bindt zich met het antigeen in het GALT tot immuuncomplexen die worden vastgehouden door folliculaire dendritische cellen in de follikels van de Peyerse platen. Hier vindt, waarschijnlijk met behulp van T-lymfocyten, een overschakeling plaats van IgM naar IgA en er ontstaan B-geheugencellen met IgA op hun oppervlak. Deze cellen circuleren met het bloed door het lichaam en nestelen zich onder meer in de mucosa van de darm. Wanneer deze B-lymfocyten opnieuw met hetzelfde antigeen in contact komen, gaan ze zich onder invloed van vrijgekomen cytokinen differentiëren tot IgA-afscheidende plasmacellen. Dit IgA wordt met behulp van de secretiecomponent naar het oppervlak van het slijmvlies getransporteerd en in het darmlumen uitgescheiden, waar het werkzaam wordt. Het IgA-geheugen valt na verloop van tijd weg en moet via IgM-cellen opnieuw worden opgebouwd. [6]
Opbouw van het GALT

Referenties
[1][PubMed] Berg R.D., Trends Microbiol. 1996 Nov;4(11):430-5.
[2]Brook, 1999.
[3]Guarner et al., 2006.
[4][PubMed] Delcenserie, 2008.
[5][Book] Maassen CBM e,a., Modulation of Cytokine expression by Lactobacilli and its possible therapeutic use, Probiotics 3, editors Fuller and Perdigon, Kluwer Academic Publ., Dordrecht, 2000, pp 76- 88.
[6] [PubMed] Brandtzaeg et al. Mucosal Immunol.2008 Jan;1(1):31-7. doi: 10.1038/mi.2007.9.